專家諮詢/部立雙和醫院胸腔內科主任 李岡遠
文字整理/ 李佳欣
「近年,免疫治療已在愈來愈多肺癌病人身上看到成功經驗。」
根據衛生福利部國民健康署的癌症登記報告,肺癌近十年來一直是台灣發生率第二高的癌症,每年平均新增一萬兩千名肺癌病患。在死亡率的排名上,不管男性或女性,肺癌更是穩居第一名。
肺癌為什麼這麼致命?主要原因有兩個,一是肺癌早期症狀並不明顯,當病患有症狀而去就醫時,往往已經是晚期。再加上過去肺癌的治療方式較少,主要還是以化療為主,一旦治療效果不好,經驗再豐富的醫師也無計可施。
不過這幾年,肺癌治療的趨勢有了很大的轉變。我記得在二○○○年前後,大多數的醫師都很怕聽到肺癌病人問:「醫生,你覺得我還可以活多久?」因為在那個年代,病人不治療,通常最多只能活六個月。但就算乖乖聽話接受化療、咬著牙承受相應而來的副作用,最後可能也很難活超過一年。
但後來病人的存活期大幅延長,愈來愈多來到診間的肺癌病人,幾乎都看不出來是癌症患者。大多可以正常工作、旅遊,回診時滔滔不絕地跟醫師分享生活的甘苦談。
這其中最主要的因素就是標靶藥物的出現。分析台灣二○○○至二○一三年肺癌治療的統計我們就可以發現,標靶治療出現後,肺癌病人的存活率便逐漸提升。尤其到了二○○七年,標靶治療納入健保給付,大幅降低了患者接受治療的門檻,存活率的增加幅度也更為明顯。(圖3-3)
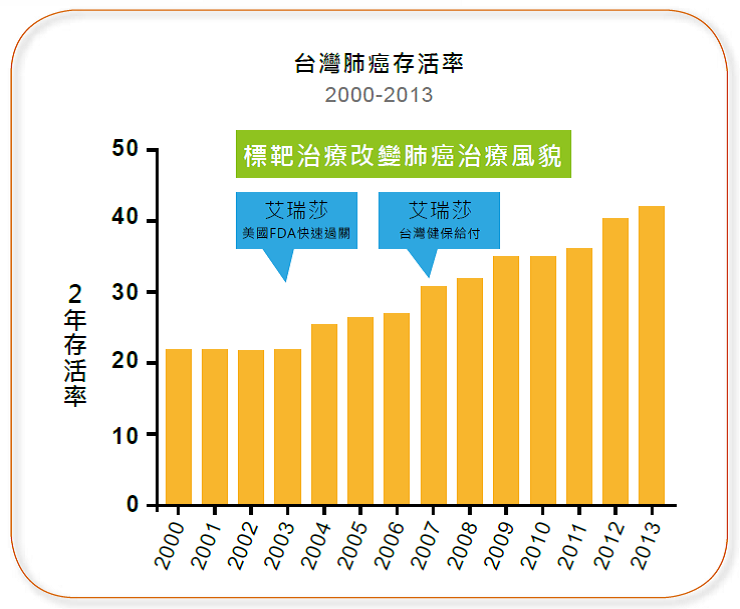
圖3-3 台灣肺癌存活率
免疫治療,已成肺癌治療的主角之一
不過,標靶治療的出現雖然為肺癌的治療增添了一項新的利器,但它在對象與療效上仍有侷限。
因為肺癌依照分化程度與型態特徵又可分為小細胞肺癌、腺癌、鱗狀細胞癌與大細胞癌,其中,只有腺癌的細胞表現能被標靶藥物有效定位。而在台灣,這類的病患只佔所有肺癌的六成五,且即使是腺癌,也必須屬於特定的基因型。
所以算一算,實際上國內肺癌的患者只有約四成能接受標靶治療。而另外六成的病患,一旦化療後效果不佳,還是會面臨到無藥可用的困境。自從免疫檢查點抑制劑問世後,肺癌的治療情況也開始轉變。尤其這三年來相關試驗非常多,許多國際案例上都可以看到,不管是哪一種類型的癌症,免疫治療都帶來了過去化療跟標靶治療中看不到的效果。
在一些早期進行的臨床試驗中,接受免疫治療(Nivolumab)的肺癌患者比起單純使用化療的病患有更高的存活率。不僅有些病患可存活超過五年,甚至還有一些人可以達到七、八年之久。事實上,五年存活期在癌症治療的定義中,已可以被認為是治癒癌症了。
而今年開始,肺癌免疫治療的相關試驗不僅持續增加,治療方式更有大幅進展,我們幾乎已經可以說,免疫檢查點抑制劑是肺癌治療的主角之一。以往的研究,免疫治療介入時機多是在二線或二線之後,近來有越來越多的研究證實將免疫治療用於第一線有更優異的表現,針對第四期而無特定基因突變的患者,單獨使用免疫藥物或和化學治療合併使用已證實比傳統化學治療有更好的療效。也有一些研究同時讓患者接受兩種免疫藥物的治療,在腫瘤基因突變量高的病人身上看起來的治療效果也不錯。
最近還有一個針對局部晚期無法手術切除的非小細胞癌【註1】的研究發現,免疫治療有預防復發的效益。舉例來說,有些病患的腫瘤緊貼心臟組織,利用手術切除腫瘤,勢必就會傷害到心臟組織,傳統上便只能採取放療搭配化療的方式來治療。但令人無奈的是,病人往往會在不到一年之後再度復發。
現在,有些研究便嘗試在標準同步化療與放療後搭配免疫治療藥物(Durvalumab),成功將病人的復發時間從治療後的五點六個月延長到了十六點八個月。現在,美國也將這種治療模式納入局部晚期腫瘤的標準治療指引中。(註:台灣也已通過此項適應症)
免疫治療的下一步:更精準預測適合族群
雖然免疫檢查點抑制劑的療效很令人期待,但平均來說,只有約百分之十六至十八的肺癌病患對治療有反應。醫學界現在的一大挑戰就是設法在治療前就精準地找出這不到兩成的幸運兒,進而提高治療的成功率。
目前醫界已經使用的方式之一是藉由腫瘤細胞上的特殊標記來辨識療效。將病人的腫瘤組織切片後進行特殊染色,觀察腫瘤細胞上的分子表現。若病人表現出較高的PD-L1 分子,代表使用抗PD-1 的免疫檢查點抑制劑時,會有較好的治療效果;反之,若PD-L1 表現的較少,療效也會通常較差。
一項第三期的臨床試驗就找出一群PD-L1 表現量大於百分之五十的病患, 讓他們在尚未接受其他治療前, 先接受抗PD-1 的免疫治療(Pembrolizumab)。結果發現只是多了一個篩選步驟,患者的整體反應率就從過去的百分之二十提高到將近百分之五十。而且總體存活期超過一年以上的比例,比起接受化療的患者還高出了兩成。
這個篩選腫瘤標記的方式對免疫治療的發展十分重要,現在國際上也陸續將這種方式視為臨床上的一種標準治療,並以腫瘤分子的表現來預測治療的結果。【註2】
另一個辦法則是依據腫瘤細胞基因的突變情況來做預測。腫瘤基因有突變的特性,一般認為細胞突變基因愈多,愈可能製造出跟正常細胞不同的蛋白質。而這樣的細胞可呈現出較強的抗原性,就好像是特徵明顯的壞人,因而容易被我們的免疫系統辨識出來。利用這個原理,醫界現在便使用一種「次世代定序儀」快速大量掃描腫瘤的基因,檢測出癌細胞的基因突變量。
試驗結果發現,腫瘤基因突變量高的病患,使用抗PD-1 的藥物效果就會比較顯著。相反的,如果基因突變量低,接受免疫治療不但效果不顯著,還比傳統的化療還要差。
不過這項檢測因為做一次要花費十多萬元,健保也沒有給付,目前無法普遍使用。
從這樣的結果也可以讓大家知道,免疫治療雖然備受矚目,但還是有其適用性的限制,並不是說免疫治療的治療就一定優於傳統治療。
事實上,過去被認為治療肺癌成效有限的化學治療,也因免疫檢查點抑制劑的出現重新獲得重視。從一個臨床試驗的結果發現,病患同時接受化療與免疫檢查點抑制劑(Pembrolizumab),腫瘤反應率可達到將近百分之五十五。但若將單純使用免疫治療或化療的效果相加,腫瘤反應率也只有不到百分之五十。而且這種「一加一大於二」的效果,就算病人PD-L1 的
現量低,也一樣能有很好的療效。
去年,我就有一位七十二歲的肝癌病患,在接受電燒治療後,又在追蹤過程中發現脾臟長了一顆腫瘤,被診斷是肺腺癌第四期的轉移。照了電腦斷層後,又發現頸部也有淋巴結的腫脹。在基因檢測後,發現患者是屬於EGFR/ALK 的基因突變陰性,也無法做標靶治療。後來,我們替患者做組織切片的染色,發現病患PD-L1 的分子表現量很高,便決定嘗試給予免疫檢查點抑制劑。現在這位病患的治療效果與生活品質都不錯。
台灣這幾年不僅核准了免疫治療藥物,也累積不少臨床試驗的案例。我們自己就看到不少病患在接受免疫治療之後,又獲得了新的希望。像是一名七十四歲、肺部鱗狀細胞癌第四期的患者,這類腫瘤對標靶沒有反應,對化療反應也不佳,後來參加臨床試驗接受免疫治療,目前腫瘤縮小,病患生活品質也不錯,已經獲得長期控制。也有肺腺癌的患者,原本腫瘤已經有多處淋巴腺轉移,因為腫瘤特定基因突變為陰性,不適合標靶治療。在嘗試免疫療法之後,患者的腫瘤也開始逐漸縮小。
看到這些過去可能要宣告放棄的肺癌病患,在免疫治療介入後情況獲得了改善,且效果也比預想中來得持久,身為醫師的我們都感到十分振奮。我們相信透過更多個人化的檢測、相關研究的交流,肺癌的患者接下來可用的治療選項一定會更多、更好!
【註1】局部晚期無法手術切除的非小細胞癌是指尚未轉移但又很難透過手術處理乾淨的第三期腫瘤。
【註2】Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate040): an open-label, non-comparative, phase 1/2 dose escalation and expansiontrial. The Lancet. JUNE 24, 2017.


